第8章経腸栄養法
8-1:経腸栄養法の適応と投与方法
■消化管は最大の免疫臓器である
A. 生命維持に最も重要な臓器:消化管
この地球上に消化管をもたない動物はいない.腔腸動物は脳やそのほかの器官ははっきりしないのに消化管は存在する.すなわち動物の生命を維持するには何よりも重要な臓器は消化管である.さらに,消化管は身体内で最も大きな免疫臓器であり,消化と吸収という機能が正常に働いている限り,正常な免疫機能を果たし,生体防御機能を司っている(図Ⅰ)(参考文献8-1-1).しかし,その消化・吸収機能が中断されるといろいろと生体にとって不都合なことが起きる.これらのことについては4-2:消化管と免疫(https://www.nutri.co.jp/nutrition/keywords/ch4-2/)で詳述される.
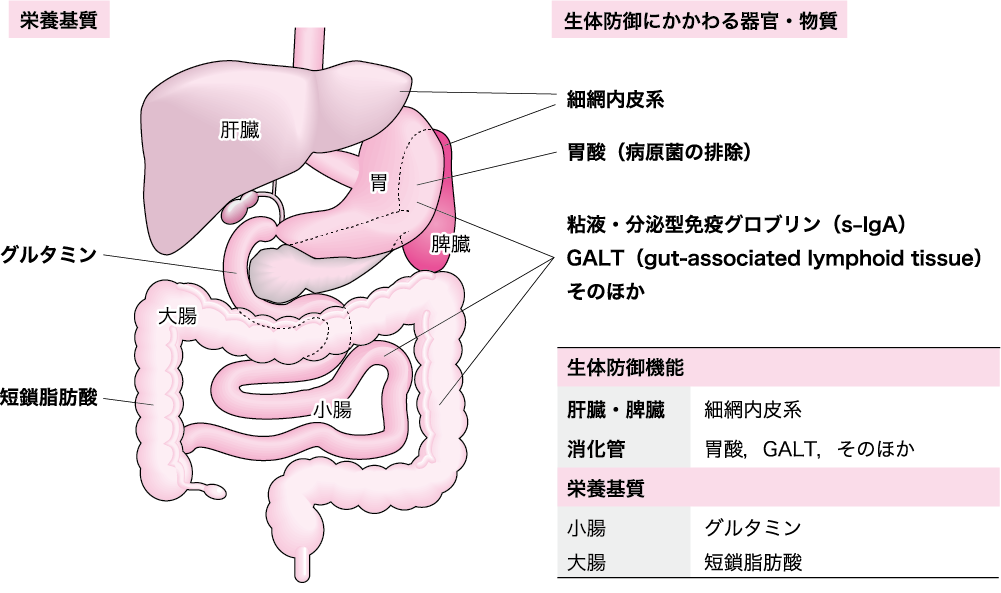
図Ⅰ●生体防御機能を司っている腹部臓器と消化管の栄養基質
胃液にはpH1 ~2 という強酸の塩酸があり,その作用により,外部からの病原性細菌はほとんど死滅する.肝臓にはクッパー星細胞があり,腸管から吸収される有害物質を解毒し,消化管には粘液,分泌型免疫グロブリンA(s-IgA)やGALT などがあり,生体内で最大の免疫臓器とされている.この 消化管の栄養基質には小腸ではグルタミンが,結腸では短鎖脂肪酸(酪酸,酢酸,プロピオン酸)が使われている
B. 消化管の栄養基質について
消化管(小腸)粘膜上皮は腸管内および血中の両者からグルタミン(GLN)を代謝基質として摂取する.GLNは溶解度(20℃水に対し,3.73%)が低く,変性しやすいために静脈栄養用の総合アミノ酸溶液には含まれていない.したがって静脈栄養下では,GLNを投与することは本邦では不可能であり,飢餓時ではGLNの供給は筋肉の崩壊に頼らざるを得ない(参考文献8-1-2).
これまでGLNは侵襲下で血中濃度が低下し,条件付き必須アミノ酸であるから,侵襲時にはこれを補った方がよい,とされてきた.しかし近年,これに対して,必ずしもそうではなくて,侵襲下でも血中GLNが高値を示す症例があり,これらの症例にGLNを投与するとかえって死亡率が高いというデータが出てきた.すなわち,血中GLN濃度と死亡率の間にはU字型の関連があるということがわかってきた(参考文献8-1-3).そこで重症患者に対するGLN投与(IV & EN)の効果についてのメタ解析を行った2つの論文が発表された(参考文献8-1-4,8-1-5).この結果を表Ⅰにまとめた.結果を簡単にまとめるとICU患者において経静脈的GLNの投与は効果がある.しかし,経腸的GLNの投与は在院日数において有意に減少したが,その他の項目については熱傷例以外には効果がなかった,ということである.
一方,大腸は経消化管栄養がなくなると粘膜が著しく萎縮する.大腸の栄養基質は短鎖脂肪酸(第2章-8 Key Word7,p.95参照)に依存している(図Ⅰ).短鎖脂肪酸はデンプンやオリゴ糖などの糖質を基質として大腸内で細菌の分解作用により産生される物質であり,静脈栄養では供給できない.
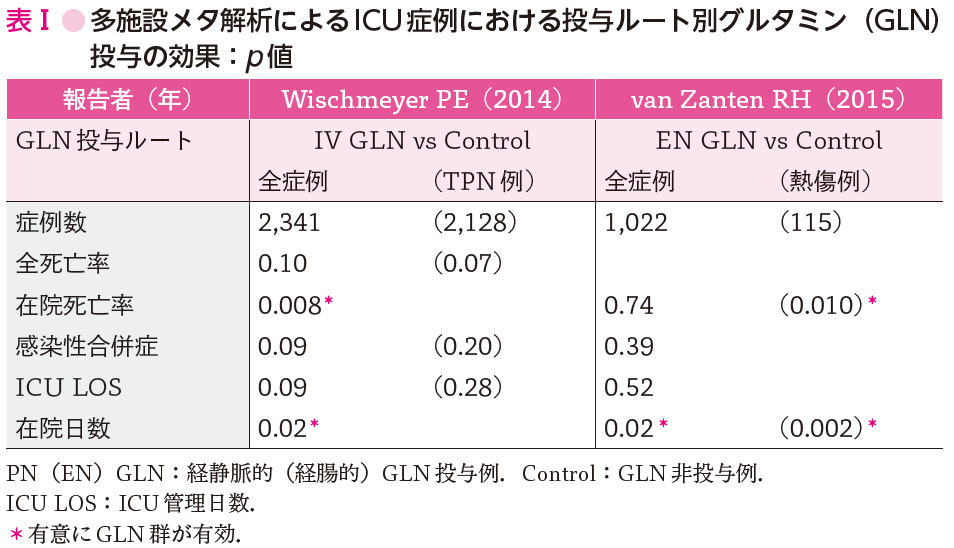
(文献8-1-4,8-1-5をもとに作成)
■経腸栄養法と静脈栄養法
A. 臨床的検討
食道がん術後の栄養管理に早期経腸栄養法と中心静脈栄養法(total parenteral nutrition:TPN)を行い比較検討した.コントロールド・スタディではないが,術後2週間までの窒素出納(第2章-3 Key Word5,p.60参照)は,経腸栄養法(enteral nutrition:EN)において術後8日目から正に転じたが,TPNでは遅れて術後14日目にやっと正になった(図Ⅱ)(参考文献8-1-6).また,食道がん術前後の血中DAO活性をみるとTPN群では有意にDAO活性は低下したが,EN群では有意の低下はみられなかった(図Ⅲ)(参考文献8-1-7).
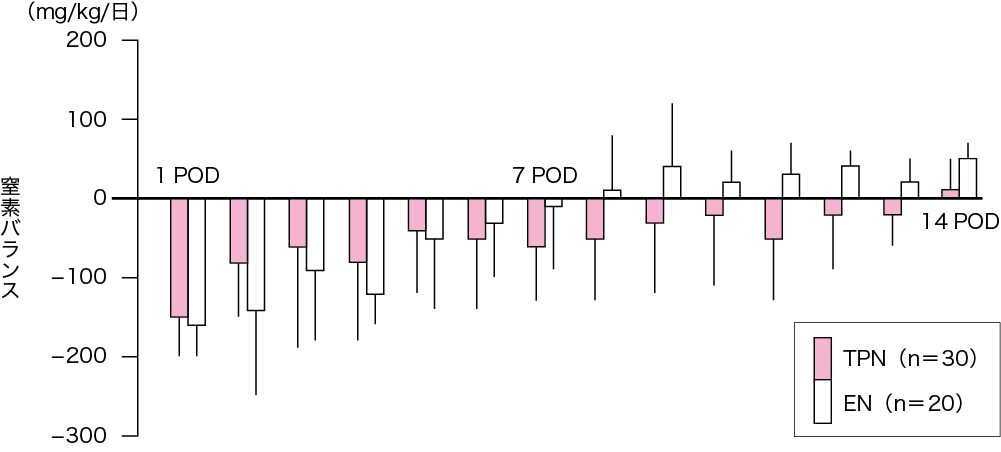
図Ⅱ●食道がん術後窒素バランス(TPN vs EN)
食道がん根治術後栄養管理において,TPN(完全静脈栄養)群とEN(経腸栄養+末梢輸液)群の窒素バランスを比較するとEN 群では8 日目で正に転じるもTPN 群では14 日目にやっと正に転じた.TPN:total parenteral nutrition, EN:enteral nutrition, POD:術後日数
(文献8-1-6より引用)
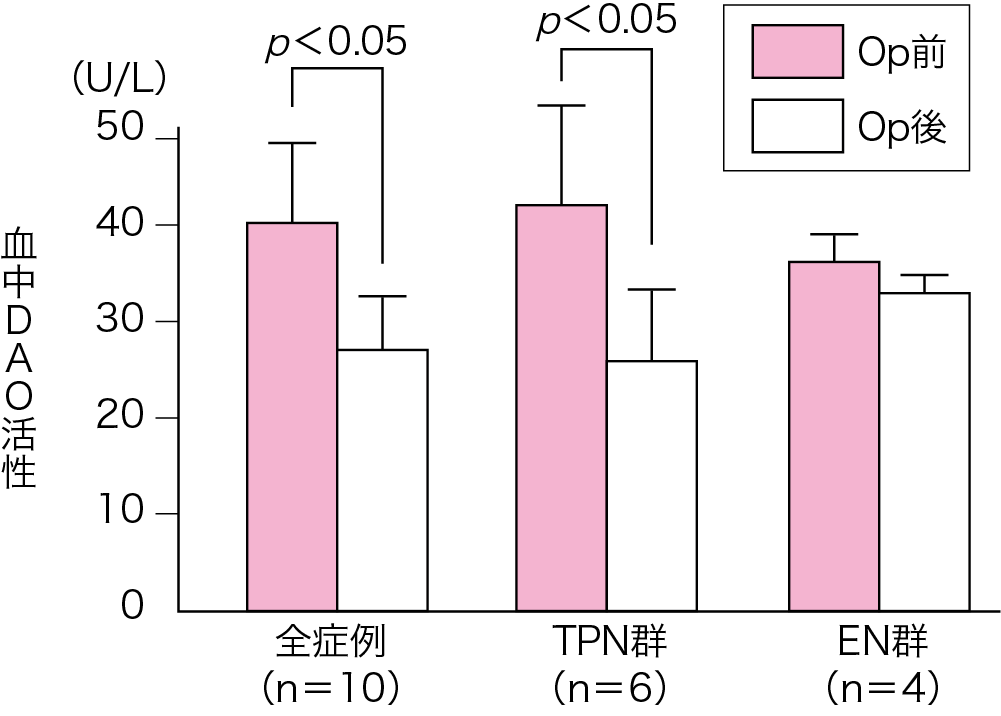
図Ⅲ● 食道がん術前後の血中
DAO 活性の推移
TPN 群のDAO 活性は術前に比して術後は有意に低下したが,
EN 群では術前後で有意差はみられなかった.
DAO:diamine oxidase
(文献8-1-7より引用)
B. 実験的検討
これらの臨床的事実をラットを用いて実験的に検討した.実験期間は6日間で,静脈栄養群(TPN群)と経腸栄養群(EN群)の2群に分けてTPN用の栄養剤を,エネルギー・窒素量を同一にしてそれぞれ中心静脈および胃瘻から投与した.実験4,5,6日目の窒素出納および6日間の累積窒素出納は有意にEN群が良好であった(図Ⅳ)(参考文献8-1-6).また,尿中のVMA(vanillylmandelic acid,カテコールアミンの最終代謝産物)排出量は実験5,6日目において有意にEN群で少なかった(参考文献8-1-6).これらのことから,TPNは生体にストレスがかかり,カテコールアミンの分泌を促進し,窒素排出量が多いのではないかと結論した.
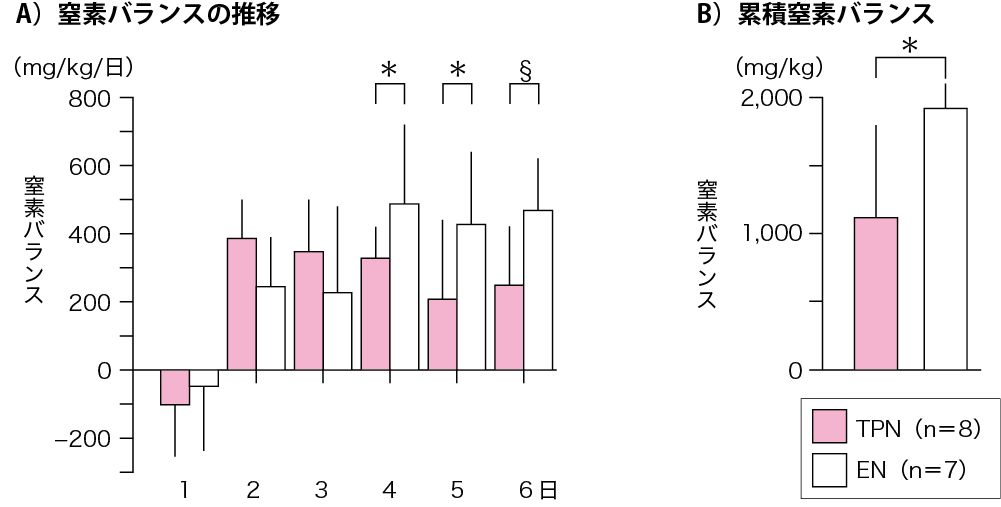
図Ⅳ●TPN 群とEN 群における窒素バランスの比較(ラット)
ラットを用いた実験において,投与エネルギーと窒素を両群で同一としたTPN 溶液を6 日間投与した.実験4,5,6 日目および実験期間中の累積窒素バランスは有意にEN 群で高値を示した.* : p<0.05, §: p<0.01
(文献8-1-6より引用)
TPNは1968年Dudrickらによって開発されたが,’74年Levineらはラットの7日間の実験において,腸管重量,粘膜重量,粘膜絨毛高が低下し,腸管上皮のDNA含有量や二糖類分解酵素活性が低下していることを発表した(参考文献8-1-8).図Ⅴはわれわれのラットを用いた実験であるが,2週間のTPNラットと固形飼料によるラットの空腸の組織像である(参考文献8-1-9).
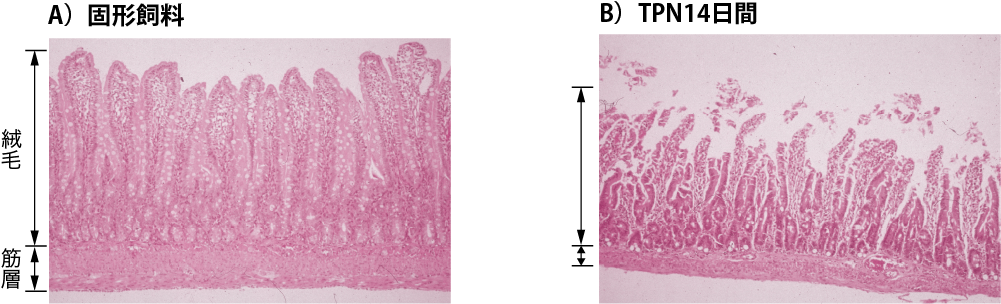
図Ⅴ●固形飼料とTPN 管理ラットの小腸組織像の比較
固形飼料ラットでは小腸絨毛の丈が高く,密生し,筋層も厚い.TPN ラットでは絨毛は丈も短く,細く,疎であり,上皮の剥離もみられる.筋層も薄く,全体に萎縮が著明である.
(カラーアトラス 図F 参照)
(文献8-1-9より引用)
TPNラットでは著しく腸管は萎縮し,粘膜絨毛高が低く,上皮の剥離が著明であることが一目で理解できる.Liらの動物実験によるとTPN施行例においては腸管および気道系のs-IgA値が開始後2日目において,すでに50%まで低下することが示された(参考文献8-1-10).これらのことより経腸栄養法の利点は次のようなことがいえる.
① 腸粘膜上皮の形態と機能を維持する
② 生体防御機能を維持する
③ 侵襲後のストレスホルモンの分泌亢進を抑制する
④ 侵襲後の代謝亢進を抑制する
⑤ 侵襲後の筋タンパクの崩壊を抑制する
■静脈栄養法との比較
近年,早期経腸栄養法の普及とともに,ENは本当に静脈栄養(parenteral nutrition:PN)よりも臨床的に良好な結果が得られているのか?ということが問われ,いくつかの施設による比較試験が検討されてきた.
Elkeらは18施設,3,347 例のICU症例のメタ解析を報告した.それによると全死亡率に は有意差なし(p=0.75).感染性合併症発生率では有意にEN群が少なかった(p=0.004).これは投与エネルギーがPN>ENにおいてより顕著であった(p=0.003)が,投与エネルギーがPN=ENでは有意差がみられなかった(p=0.44).さらにICU管理日数においては EN群が有意に短かった(p=0.0003)が在院日数や人工呼吸器管理日数には有意差はなかった.ここで重要なことは感染性合併症がEN群で少なかったということである.しかし,これらの結果はENルートが勝るというよりも投与エネルギーがPNルートよりも少ないことに起因している可能性があったのかもしれない(参考文献8-1-11).その答えになるような論文がRidleyらによって発表された.ICUの6施設から100例についてのパイロット・スタディである.ENではどうしても投与エネルギーとタンパク質が不足するので不足分をPNで補った群とENだけの群との比較を行った.7日間の施行期間で結局,臨床的,機能的有意差は両群でみられなかった,と報告した(参考文献8-1-12).
2011年Casaerは同様にICU入室後7日間の栄養投与でEN+PN群よりもENだけの群 が良好な臨床結果を示すことを報告し,EN+PN群ではオートファジーが障害されているであろうと述べている(参考文献8-1-13).
■経腸栄養法の適応
経腸栄養法の適応とされる病態は広く,「腸管が一部でも機能していれば,経腸栄養の適応である」とされている.また,TPNの絶対的適応以外はすべて経腸栄養法の適応といえる.経腸栄養法の適応を考える際はまず,消化管が安全に使えることが大前提である.次にその栄養管理期間を考える.だいたい4週間をめどにして,それ以内の栄養管理期間であれば,経鼻経管栄養法を選択し,4週間以上にわたる栄養管理期間であれば胃瘻または空腸瘻を用いた方法を考慮する.次に胃・食道逆流の有無を考慮する.逆流の危険性がなければ短期の場合,経鼻・胃ルートを,長期の場合は胃瘻を採用し,逆流の危険があれば,短期では経鼻・幽門後ルートを,長期の場合には空腸瘻あるいはPEG(経皮内視鏡的胃瘻造設術)の瘻孔を利用してそこから長いチューブを空腸の起始部に留置して栄養投与を行う方法(PEG-J)または外科的空腸瘻造設を採用する.

■投与方法
A. 経腸栄養剤の選択
経腸栄養法を施行するにはまず栄養剤の選択が必要である.栄養剤の一般的な分類を表Ⅱに示した.経腸栄養剤の選択において最も重要なことは病態に合った栄養剤を選択することである.それには個々の栄養剤の組成を十分検討して選択する.病態が安定して,ストレスがほとんどない場合には半消化態栄養剤(LRD)の一般処方群を選択し,ストレス下,耐糖能異常時,腎不全,肝不全あるいは呼吸不全などでは,それぞれの病態に応じた特殊処方の栄養剤を選択する.また,短腸症候群や,クローン病の場合には成分栄養剤の選択もすべきである.それによっておのずと投与方法も決まってくる.本邦では,経腸栄養剤は医薬品と食品に分類されている.食品の場合,微量元素は添加することはできず,原料由来の含有量になっている.そのために含まれるべき個々の栄養組成の含有量にも特に決まったものはない.これに対してヨーロッパでは経腸栄養剤はすべてFSMPs(foods for special medical purposes:特別医療用食品)として厳格な規制のもとに各栄養素の含有量も一定範囲で決められていて定期的に検査が施行される.医療保険の適用もある.
B. 経腸栄養法施行に必要な器具
① デカンター
栄養剤を詰め替えて投与する場合に必要である.ボトルタイプ,バッグタイプあるいはイリゲーターなどがある.デカンターを使用する場合にはオープン・システムで投与しなくてはならないので,細菌汚染に注意しなくてはならない.成分栄養剤はすべてデカンターが必要である.近年,半消化態栄養剤ではデカンターを必要としないバッグ詰めの製品が多く,これらはクローズド・システムで投与できるし,ポンプも使用できる.
② 経鼻栄養チューブ
経腸栄養法の欠点は経鼻的に栄養チューブを消化管に留置しなくてはならないことである.患者もこれが苦痛のために経腸栄養法を拒否し,また,医師もこのために安易にTPNを選択してしまう.そこで,いかに患者の違和感を最小にするかということを考えて経鼻栄養チューブの選択を行わなくてはならない.まず,できるだけ細いチューブを選択する.一般的なLRDを投与する場合は8 Frもあれば十分である.栄養チューブの材質にも注意を払わなくてはならない.経鼻・胃用と経鼻・小腸用があり,先端に錘がついているものがある.経鼻・胃用では錘は必要ないが,留置しやすいようにガイドワイヤー付きのチューブを選択する.先端が盲端となり側孔のあるタイプは最も閉塞しやすい.側孔でも舟状(スプーン状)の注入孔タイプは閉塞しにくい.また,チューブを固定する場合にはエレファント・ノース型(p.211,図1)に固定し,毎日絆創膏を交換して皮膚を清潔に保つことはいうまでもない.
③ 経腸栄養専用注入ポンプ
病態が安定して,胃・食道逆流の危険がなくチューブの先端を胃内に置いて,間歇的に注入する場合にはポンプは必要ない.しかし,侵襲下や幽門後に注入する場合にはポンプは必須である.また,胃・食道逆流の危険があり,幽門後栄養投与が困難で胃内投与を余儀なくされる場合にもポンプを使用すると逆流を防止することが可能である.いずれにしても経腸栄養法を成功させるにはポンプは必須である.
C. 投与ルート
① 経鼻・胃ルート
最も一般的なルートであり,技術的にも容易で間歇投与が可能である.チューブの先端の位置確認は必ずX線透視あるいは撮影によって確認する.あるいはチューブから吸引した液体のpHが4以下の酸性であることを確認する.注射器にて空気を送り上腹部でその注入音を聴診器で聞いて確認することがよく推奨されているが,この方法には問題があり,気道や食道下部にチューブが留置されていても上腹部で空気注入音が聞こえることがあるので注意を要する.
② 経鼻・幽門後ルート
胃・食道逆流の危険がある症例や,早期経腸栄養法を行う場合に選択するルートである.幽門を越えてチューブの先端を十二指腸,あるいはトライツ靱帯を越えて空腸上部に留置させる方法である.チューブの留置方法は若干の技術を要し,先端に錘があり,ガイドワイヤー付きのチューブを使用する.ベッドサイドで留置する場合には吸引液の性状やpHを測定して幽門後に留置する.しかし細い栄養チューブでは消化液を吸引できない場合がある.X線透視下に留置するのが最も確実である.空腸上部に先端を留置できれば最も理想的であるが,十二指腸の水平部までもっていき,長めに胃内にたるませておくと,蠕動運動でトライツ靱帯を越えて空腸上部まで先端が進むことが多い.内視鏡下に留置する方法もあるが,内視鏡を抜くときに留置した栄養チューブも一緒に抜ける場合がある.
③ 胃瘻
経皮内視鏡的胃瘻造設術(PEG)と外科的方法により作成する方法がある.PEGは本章-3,p.217に述べられるので省略する.外科的方法には,Stamm法,Whitzel法,Janeway法などがある.
④ 空腸瘻
PEGを介してチューブの先端を空腸上部に位置させる方法(PEG-J)および外科的に作成する方法がある.PEGを介する方法の詳細はPEGの項にゆずる.外科的方法は多くは食道がんや膵臓がんあるいは胃がんなどの手術の際に作成されることが多い.多くはWhitzel法に準じて作成される.図Ⅵはわれわれが開発した空腸瘻専用栄養チューブであり,図Ⅶが手術時に留置した完成図である(参考文献8-1-14).
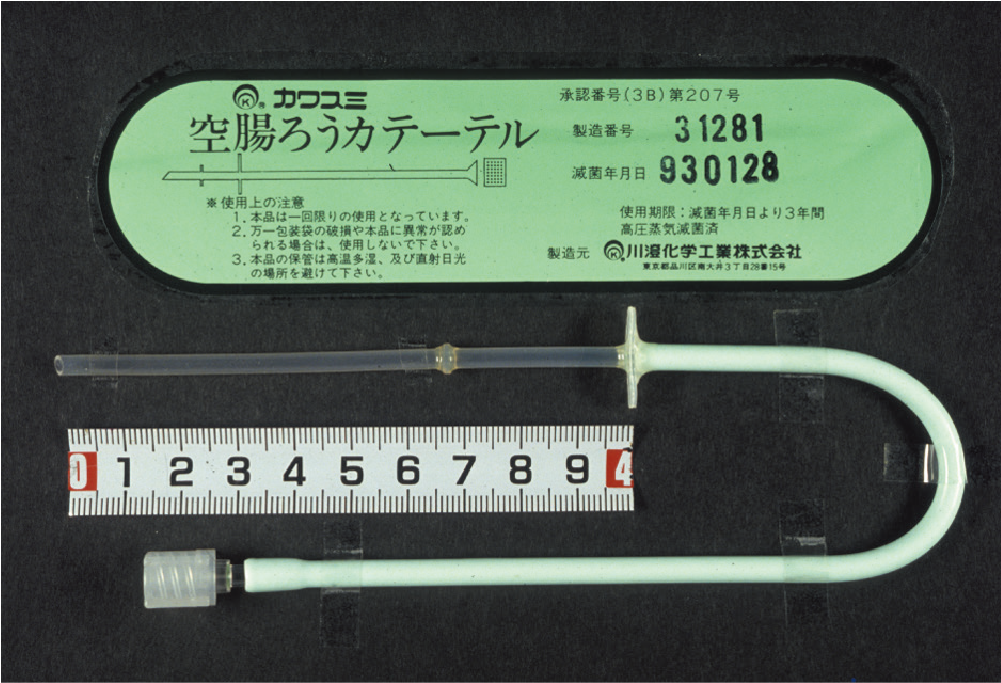
図Ⅵ●空腸栄養瘻専用カテーテル
われわれが考案した空腸栄養瘻専用カテーテルである.透明部分の10 cm が10 Fr で先端から7 cm の部位にノッチがあり,さらに3 cm の部位にウィングがある.ウィングからライン接続部分まで約15 cm あり12 Fr の大きさになっている.材質はシリコン.
(文献8-1-14より引用)
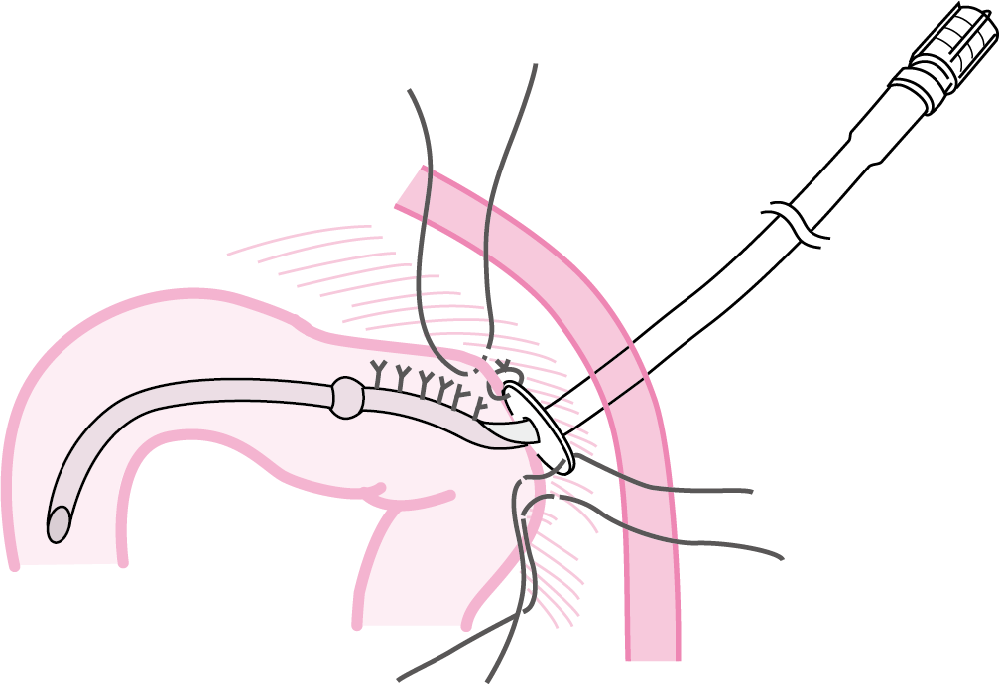
図Ⅶ●空腸栄養瘻専用カテーテルの留置完成
トライツ靱帯から約40 cm の空腸に縦に約3 cm の漿膜・筋層切開をおき,その遠位側で粘膜に小孔を開け,カテーテル先端からノッチまでを腸管内に留置する.腸管内容が漏れないように粘膜孔を3-0 絹糸で閉じ,それよりウィングまでを漿膜・筋層でWhitzel タイプに被い,ウィングを腹膜に数針固定して,体外に誘導する.
(文献8-1-14より引用)
⑤ needle catheter jejunostomy (参考文献8-1-15)
この方法は手術に併設されるものであるが,さらに簡単で,外套針をガイドとして作成するのでチューブの外径が6 Frと細く,成分栄養剤の投与を前提としている.これらの方法は早期経腸栄養を可能にするもので,手術終了後循環動態が安定していれば,翌日からでも投与可能であり,これによってほとんどの腹部の大手術後でもTPNを必要としない.
D. 投与速度
間歇投与は胃内投与が原則である.1日量を3~4回に分けて投与する.まず最初は1回200~250 mLを約1時間ほどで注入し,特に副作用がなければ500 mLを1時間ほどで投与する.持続投与は幽門後に投与する場合で,注入ポンプが必要である.最初は10~20 mL/時の速度で開始して,副作用がなければ8~24時間ごとに40 mL/時,60 mL/時,80 mL/時と速度を上げていく.24時間持続で投与するので,栄養剤の細菌汚染を防止するためにデカンターは6~8時間ごとに交換する.
 製品情報
製品情報
 よくあるご質問
よくあるご質問
 ご家庭向け製品情報
ご家庭向け製品情報
 医療機関・介護従事者向け情報
医療機関・介護従事者向け情報
 企業情報
企業情報
 公式通販
公式通販

![嚥下障害と誤嚥性肺炎[学ぶ&ケア]](/images/b_aside_nav_dysphagia.jpg)



![ご自宅で介護する方へ あなたの「おやっ?」は、床ずれのサインかも[学ぶ&ケア]](/top_new/images/recommend/p_recommend_pressureulcer.jpg)

![嚥下障害と誤嚥性肺炎[学ぶ&ケア]](/top_new/images/recommend/p_recommend_03.jpg)








