第3章侵襲に対する生体反応
3-3:飢餓と侵襲に対する生体反応の違い
■はじめに
生体に侵襲が加わると,生体は内部環境を維持し損傷を修復しつつ感染防御能を高めるためにさまざまな反応を引き起こす.これらの反応は生体が侵襲を克服しその生命を維持するために必要不可欠なものである.一方,生体にとって飢餓は,古くから最も生命をおびやかす現象の1つであり続けたし,医学の進んだ今日でも驚くほど多くの低栄養患者が存在している事実から現在でも大きな問題であることに変わりはない.生体は侵襲同様,飢餓に対しても適応し生命を維持するための生体反応を引き起こす.飢餓と侵襲は,患者が遭遇する代表的な病態であるが,それぞれに対する生体反応は大きく異なっている.本節では,それぞれの病態における代謝の変化を述べるとともに,飢餓状態に侵襲が加わった場合の生体反応について最近のわれわれの知見を中心に説明する.さらに,本来の飢餓ではないが,中心静脈栄養管理時など消化管内腔に直接栄養が供給されない状況(消化管の飢餓状態)で生じる生体反応の変化についても説明を加える.
■飢餓時の代謝の変化
飢餓時には生体のエネルギー需要を充足するだけの十分な栄養が外部から補給されない.そのため生体は体内に貯蔵されているグリコーゲンや筋タンパク,脂肪を動員して不足分を補う.しかし,飢餓が長期間に及べば臓器のエネルギー利用パターンを変化させ,外部への窒素放出を極力抑え体タンパクの維持を図る.
A. 短期飢餓時
5日以内の短期間の飢餓時には,生体は筋タンパクと体脂肪をエネルギー需要(25 kcal/kgの基礎代謝量)を満たすために使用する.グルカゴンやノルアドレナリン,バソプレシン,アンジオテンシンⅡの働きによって体内のグリコーゲンが分解されグルコースが供給される.グリコーゲンの貯蔵量は成人で300~400 gに及ぶが,その70%は筋組織に蓄積されており全身へのグルコース供給源としては機能しない.したがって,全身へのグルコース供給は肝グリコーゲンによってまかなわれるが,貯蔵量は少なくわずか十数時間内に枯渇してしまう.そこで,骨格筋や赤血球・白血球における解糖で生じた乳酸やピルビン酸から,肝で糖が新生される.しかし,この系(コリ回路)による糖新生では全身の糖需要を満たすことができないため,筋肉を中心とした体タンパクの分解によって生じたアラニンが糖新生に利用される(図Ⅰ)(参考文献3-3-1).
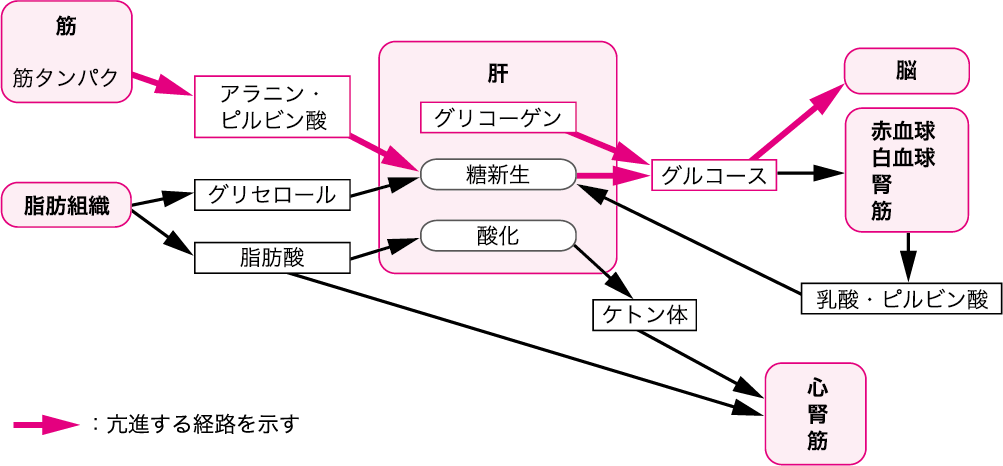
図Ⅰ●飢餓初期の代謝の変化
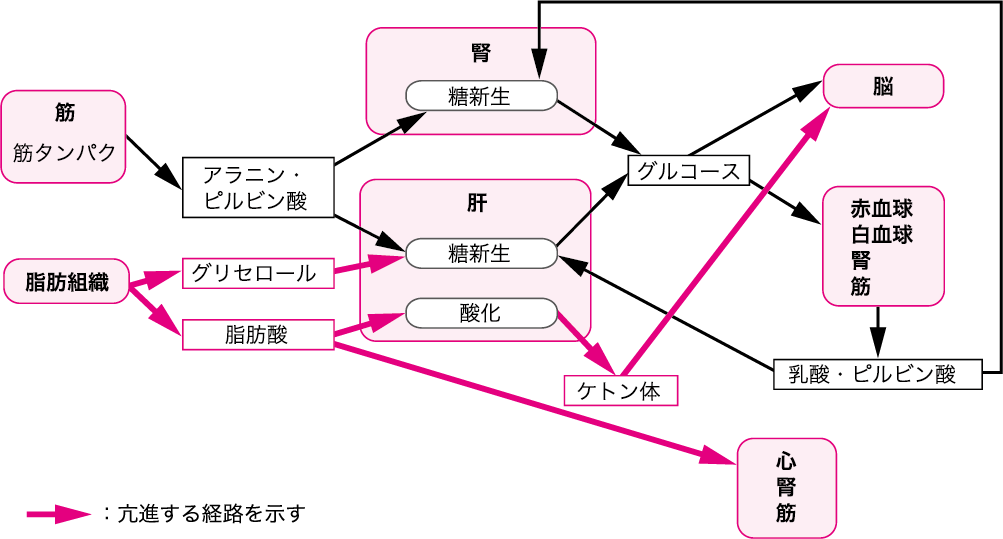
図Ⅱ●飢餓後期の代謝の変化
B. 長期飢餓時
飢餓が長期に及ぶ場合は,体タンパクの崩壊・尿中への窒素分泌が減少し,体タンパクの維持・臓器機能の維持を図る.これは,脳や心筋,骨格筋などの重要臓器がエネルギー基質として脂肪を消費するように適応することによる.インスリンレベルの低下とグルカゴン,カテコールアミンの上昇は,脂肪組織中からの遊離脂肪酸の放出を高め,遊離脂肪酸とケトン体がエネルギー源として利用される.長期の飢餓時には肝に加え腎も糖新生の主要臓器となり,グルタミンやグルタミン酸を糖に変換する(図Ⅱ).
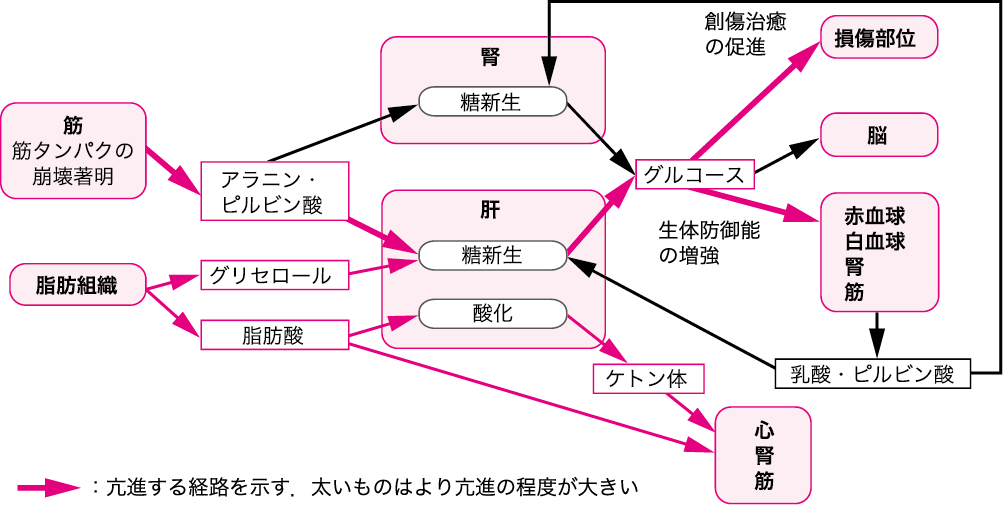
図Ⅲ●侵襲時の代謝の変化
■侵襲時の代謝の変化
侵襲後早期には体液量減少性ショックを呈し,血行動態が不安定になる.この時期には生命維持が優先され,心拍出量・酸素消費量・代謝率が減少する.しかし,その後は,グルココルチコイド(糖質コルチコイド)・グルカゴン・カテコールアミンの分泌が高まり代謝が亢進し,侵襲に伴う組織損傷の修復,外部からの病原体の侵入を防ぐために免疫系を活性化させる.脂肪組織からはグリセロール・脂肪酸が,肝臓からはグリコーゲンが分解されグルコースが,筋組織からはアミノ酸が放出され,エネルギー源として使用される.脂肪酸はそのままあるいは肝でケトン体に変換されて心・腎・筋のエネルギー源として使用される.筋から放出されたアミノ酸と脂肪組織から放出されるグリセロールは肝・腎における糖新生に利用され,産生されたグルコースは創傷部位や血球・神経系・腎・筋で使用される(図Ⅲ)(参考文献3-3-1).
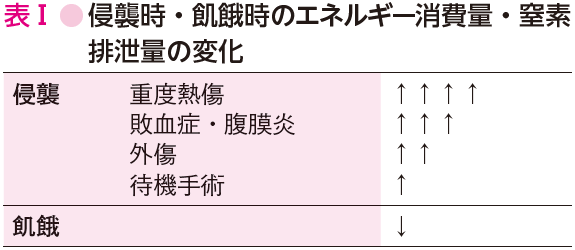
飢餓時の代謝の変化との相違は,飢餓時には代謝が低下し窒素排泄を抑え体タンパク維持に向かうのに対し,侵襲時には侵襲の大きさに応じて代謝が亢進することである(表Ⅰ)(参考文献3-3-2).したがって,侵襲時には外部からの栄養補給が十分に行われないと,急速な体タンパクの喪失・体重減少が生じてしまう.
■飢餓時に侵襲が加わった場合の生体反応
前述したように飢餓と侵襲では生体の代謝の変化が異なる.しかし,飢餓状態の生体に強い侵襲が加わる,あるいは強い侵襲が加わった結果,栄養摂取が不十分となり飢餓状態に陥るという病態は,外科領域・救急集中治療領域でしばしば経験される.飢餓によって侵襲時の生体反応がどのように修飾されるか基礎研究のデータを中心に述べる.

A. 感染性侵襲
以前から飢餓,栄養不良患者では,感染性合併症の発生が多く,創傷治癒が遅延し,その結果,入院期間が延長し医療費の増加を招くことが知られていた.その機序の一端を明らかにするため,飢餓状態のモデルとしてマウスの栄養摂取量制限モデルを作製し,腹腔内細菌汚染時の腹腔内白血球を中心とした感染防御機構の変化を検討した.
マウスに自由経口食餌摂取,あるいはその半分もしくは4分の1の食餌を与え1週間管理した後,化学的腹膜炎を惹起するため腹腔内にグリコーゲンを投与すると,自由摂取群では,早期の腹腔内滲出好中球数増加が認められたが,栄養制限群ではいずれもその増加が遅れて生じた.また,流血中の好中球のCD11b, CD18発現レベルが栄養制限群で低下した.腹腔内のTNF-α(tumor necrosis factor-α),IL-6,MIP-2(macrophage inflammatory protein-2)レベルはいずれも自由摂取群では早期に上昇したが,栄養制限群ではわずかな上昇にとどまった(参考文献3-3-3).同モデルで腹腔内常在白血球・滲出白血球を採取してin vitroでfMLP(formyl-Met-Leu-Phe)刺激下に培養すると,通常量食餌摂取群では細胞内チロシンキナーゼの活性化が高まるが栄養制限群では活性化増強は認められなかった(参考文献3-3-4).同様の現象は細胞内MAPキナーゼ(mitogen-activated protein kinase:MAPK)であるERK(extracellular signal-regulated kinase)の活性化でも観察された(参考文献3-3-5).これら,細胞内シグナル伝達活性化・流血中および腹腔内白血球活性化・腹腔内サイトカイン反応の低下に関連して,栄養制限群では盲腸結紮穿刺による腹膜炎作製時の生存が自由摂取群に比べて悪化した(表Ⅱ).
これらの結果は,飢餓時,栄養不足時には,本来腹腔内汚染時に活性化する生体防御系が鈍化してしまうことを示唆している.われわれは,同様のモデルで,腸管免疫の変化や肝免疫の変化について検討を行っている.栄養制限時には粘膜免疫の誘導器官であるパイエル板のリンパ球数の減少がみられるし,肝単核球の減少と機能低下が観察されている.すなわち,飢餓時には,① 代謝の点では適応し体タンパク維持に向かうが感染防御能は低下している,② 飢餓時に感染性侵襲が加わると通常みられる免疫系の活性化が鈍化・遅延するため予後不良となる,といえよう.

B. 非感染性侵襲
近年,侵襲時の生体反応に関する研究が進み,侵襲に伴って生じる組織傷害・臓器不全の原因として宿主自体の免疫系細胞の過剰活性化が重要であることが判明した.特に,過剰に活性化した好中球は,大量のフリーラジカルを産生しタンパク分解酵素を放出するため臓器障害の主体として認識されている.前述したように栄養不良時に免疫担当細胞の侵襲に対する活性化が鈍化するのであれば,非感染性侵襲時にはそれらの細胞による臓器障害が軽減し,結果として予後が改善する可能性もある.
そこで,われわれは,ショック・外傷・大手術後の臓器不全のメカニズムとして注目されている腸管虚血再灌流のマウスモデルを用いて,侵襲前の栄養制限(飢餓)が生体反応に及ぼす影響を検討した.マウスを自由摂食あるいはその70%,40%の食餌で1週間管理後,上腸間膜動脈を15分間クランプ,その後クランプ解除し,腸管虚血再灌流を加えた.その結果,予期したように流血中の好中球・単球の活性化は食餌制限群で自由摂食群に比べ,CD11b発現・活性酸素の産生・核内転写因子NF-κB(nuclear factor-κB)の核内への移動などの点から低下していた.しかし,同時に小腸の抗酸化物質であるグルタチオンのレベルが食餌制限群で低下しており,肺・肝・小腸の臓器障害の程度は病理学的に増悪,生存も悪化した(表Ⅲ)(参考文献3-3-6).
これらの結果から,非感染性の侵襲時にも飢餓状態にある生体は抵抗性が低下すると考えられる.組織の攻撃因子の減弱にもかかわらず抵抗性が低下することから,その機序としては,防御因子の減弱が重要と推察される.
■消化管の飢餓状態によって生じる生体反応の異常
飢餓が感染性侵襲・非感染性侵襲のいずれに対しても,生体防御能の低下を招き,予後を増悪させることを前述した.中心静脈栄養管理(TPN)は,進行性の栄養不良を防ぐことが可能であるが,消化管内腔への栄養投与が欠如するという点で,消化管の飢餓状態を引き起こすともいえる.この消化管の飢餓状態は,本来の飢餓同様,侵襲に対する生体防御能を低下させることが基礎研究によって明らかになっている(図Ⅳ)(参考文献3-3-7).このため,細菌性肺炎や呼吸器ウイルス感染,腸管内・門脈内への緑膿菌大量投与,細菌性腹膜炎モデルでの生存が,経腸的な栄養管理を受けていた群に比べ悪化する.早期経腸栄養や栄養管理法として経口摂取・経腸栄養が推奨されるゆえんである.
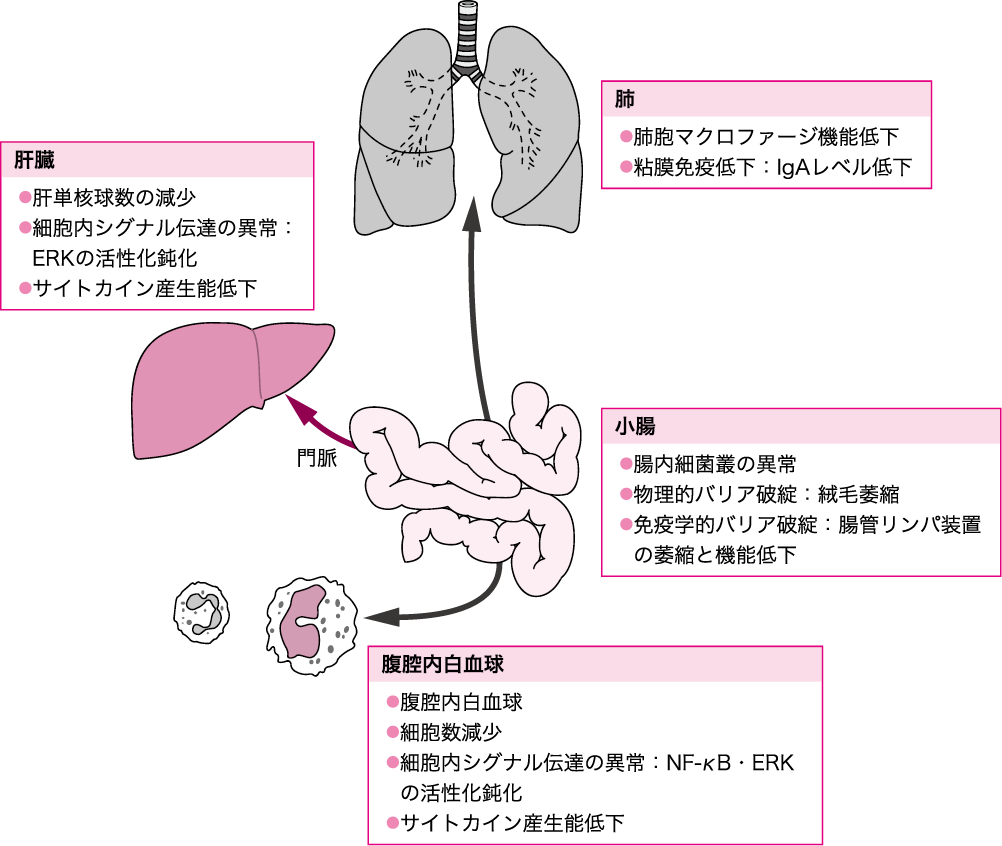
図Ⅳ●消化管の飢餓によって惹起される生体防御能低下
■おわりに
飢餓と侵襲に対して生体は必要とされるエネルギーの産生を満たすために代謝を変動させる.しかし,飢餓では体タンパクの崩壊を最小限に抑えるように,代謝率の低下・エネルギー基質の糖からケトン体への変換で対応するのに対し,侵襲時には侵襲の大きさに比例して代謝を亢進させ大量のタンパク異化を引き起こす.それは,侵襲時の生体防御能を高めるために不可欠な反応で,飢餓状態で大きな侵襲が加わると生体は防御機構を強化することができず生命の危機に直面する.侵襲に対し適切な生体反応を生じ生命を維持するためには,侵襲前・後の飢餓状態の回避・適切な栄養管理が重要である.
 製品情報
製品情報
 よくあるご質問
よくあるご質問
 ご家庭向け製品情報
ご家庭向け製品情報
 医療機関・介護従事者向け情報
医療機関・介護従事者向け情報
 企業情報
企業情報
 公式通販
公式通販

![嚥下障害と誤嚥性肺炎[学ぶ&ケア]](/images/b_aside_nav_dysphagia.jpg)



![ご自宅で介護する方へ あなたの「おやっ?」は、床ずれのサインかも[学ぶ&ケア]](/top_new/images/recommend/p_recommend_pressureulcer.jpg)

![嚥下障害と誤嚥性肺炎[学ぶ&ケア]](/top_new/images/recommend/p_recommend_03.jpg)








