第2章栄養素とその代謝
2-3:タンパク質代謝
■タンパク質とは
タンパク質とは,生体の主要構成成分の1つであり,20種類のアミノ酸がペプチド結合により重合したポリペプチドを基本構造とする.ヒトでは体重の約15%をタンパク質が占め,酵素反応,筋収縮をはじめとして,物質輸送や防御反応などの化学反応などに関与している.このように,タンパク質は体構成成分として重要であるのに加え,1 gあたり4 kcalの燃焼値をもちエネルギー源としても重要である.
食事中のタンパク質は,その構成アミノ酸によって栄養価が異なり,特に必須アミノ酸がバランスよく含まれる動物性食品は,栄養価が高い.タンパク質は,加熱,凍結,酸,アルカリ,撹拌などにより変性し,これらの作用はタンパク質の機能や性質に影響を及ぼす.
■タンパク質の消化と吸収(図Ⅰ)
食事として摂取したタンパク質は,その構成要素であるアミノ酸,あるいはアミノ酸が2~3個結合しているだけの低分子物質(ジペプチド,トリペプチド)になってはじめて吸収される.
口腔内で機械的にかみ砕かれたタンパク質が最初に化学変化をする場所は,胃である.胃ではタンパク質分解酵素(消化酵素)のペプシンの作用により,タンパク質のペプチド結合が切断され,分子量の小さいプロテオース,さらにもっと低分子量のペプトンとよばれるポリペプチドまで加水分解される.
部分的に消化されたポリペプチドは幽門を通り,十二指腸に移行し,小腸内で膵液中に含まれる別のタンパク質分解酵素であるトリプシン,キモトリプシン,エラスターゼ,カルボキシペプチダーゼなどの作用を受ける.
小腸粘膜から吸収されるのは必ずしも1つひとつの遊離アミノ酸である必要はなく,2~3個のアミノ酸からなるジペプチドあるいはトリペプチドのままでも吸収される.
これらのペプチドは,小腸粘膜上皮細胞の微絨毛(刷子縁)膜の細胞質中の酵素(ペプチダーゼ)でバラバラにされて遊離アミノ酸となり,粘膜下組織の毛細血管から,門脈系を経て肝臓に運ばれる.
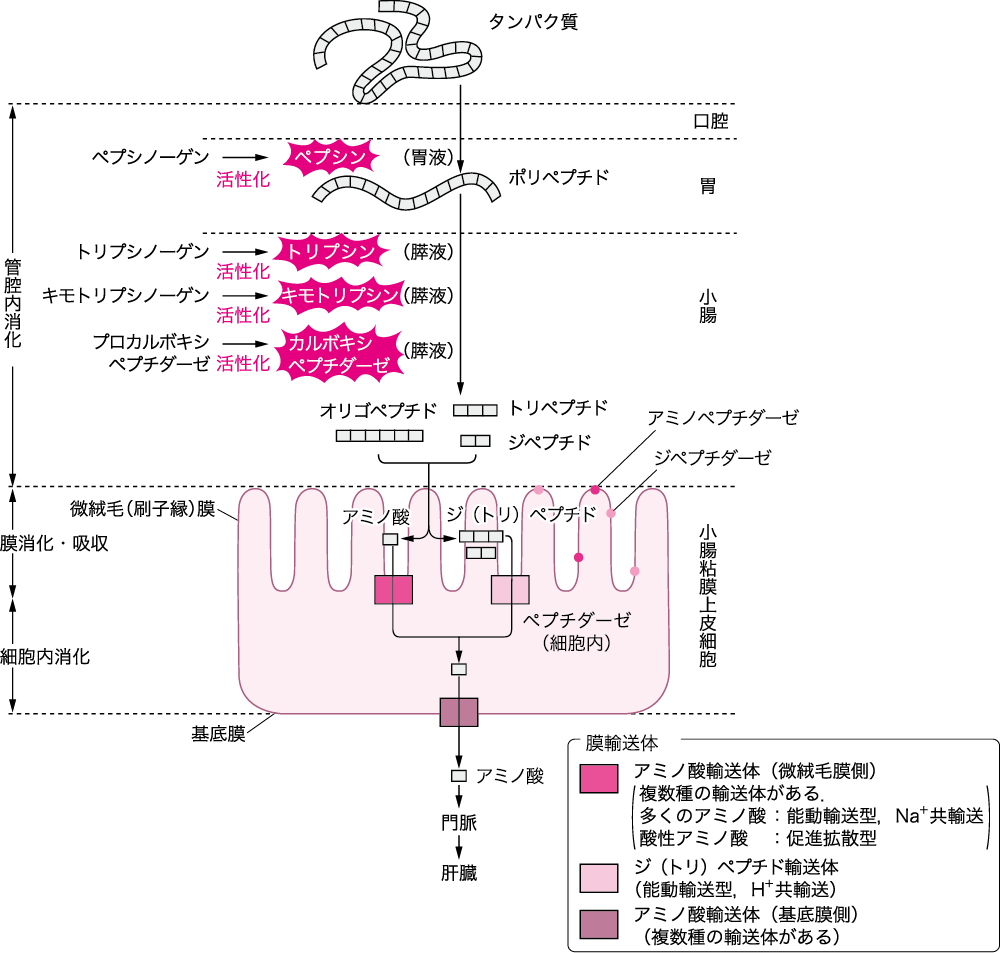
図Ⅰ●タンパク質の消化・吸収
(文献2-3-1より引用)
■アミノ酸の代謝(図Ⅱ)
食事により取り込まれたタンパク質は,アミノ酸となって吸収され,その一部は遊離アミノ酸として存在している.遊離アミノ酸は体内で一定量が蓄えられており,この蓄えをアミノ酸プールという.アミノ酸は主にタンパク質合成に利用されるが,タンパク質分解によって得られたアミノ酸が体タンパク質の合成に必要のないものの場合や必要量以上のアミノ酸が摂取された場合,また飢餓や糖尿病など糖質がエネルギー源として利用できない場合は,タンパク質が分解されエネルギー源として使われる.
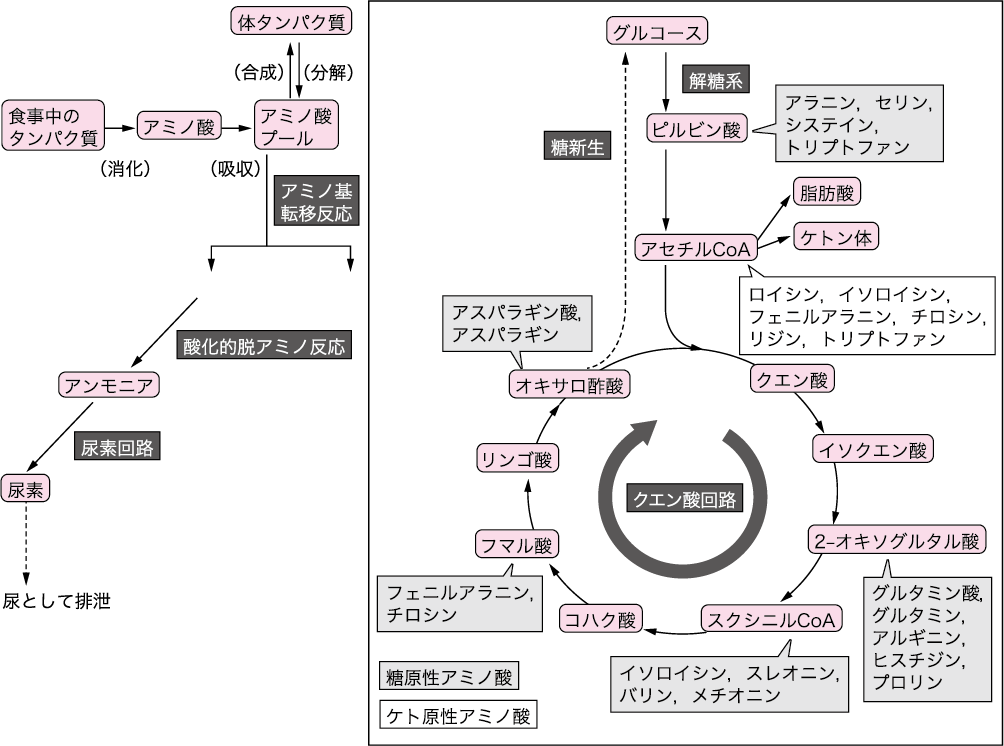
図Ⅱ●アミノ酸代謝の概要
糖質や脂質は完全に酸化されると,水と二酸化炭素になる.同様に,タンパク質(アミノ酸)中の炭素は,エネルギー源として酸化されて二酸化炭素となるが,アミノ酸のアミノ基は,有毒なアンモニア(NH3)になってしまう.そこで,エネルギーを消費しながら,肝臓でアンモニアを尿素に変換し,無毒化するしくみが備わっている.アミノ酸の窒素成分の代謝では,各アミノ酸は,まず2-オキソグルタル酸にアミノ基を転移してグルタミン酸となる.この反応をアミノ基転移反応とよんでいる.この反応には,肝機能検査として臨床診断でも使用されているアスパラギン酸アミノトランスフェラーゼ(AST)とアラニンアミノトランスフェラーゼ(ALT)が代表的な酵素として働いている.続いて,グルタミン酸に転移したアミノ基は,酸化的脱アミノ反応によってアンモニアとして遊離する.このアンモニアは,肝臓の尿素回路で尿素に変換され,最終的に尿中に排泄される.
アミノ酸からアミノ基が外れた炭素骨格は,糖代謝経路に合流する.合流場所は,ピルビン酸,アセチルCoA,クエン酸回路の3カ所である.主にピルビン酸に合流するアラニンとセリンや,クエン酸回路に入るグルタミン酸とアスパラギン酸などのアミノ酸はグルコースをつくり出す(糖新生)ため,糖原性アミノ酸という.ロイシン,イソロイシン,フェニルアラニン,チロシンはアセチルCoAから脂肪酸やケトン体になるため,ケト原性アミノ酸という.なお,ロイシンとリジン以外のケト原性アミノ酸は,糖原性アミノ酸でもある.
 製品情報
製品情報
 よくあるご質問
よくあるご質問
 ご家庭向け製品情報
ご家庭向け製品情報
 医療機関・介護従事者向け情報
医療機関・介護従事者向け情報
 企業情報
企業情報
 公式通販
公式通販

![嚥下障害と誤嚥性肺炎[学ぶ&ケア]](/images/b_aside_nav_dysphagia.jpg)



![ご自宅で介護する方へ あなたの「おやっ?」は、床ずれのサインかも[学ぶ&ケア]](/top_new/images/recommend/p_recommend_pressureulcer.jpg)

![嚥下障害と誤嚥性肺炎[学ぶ&ケア]](/top_new/images/recommend/p_recommend_03.jpg)








